CARBONO COMO FUENTE DE HIDROCARBUROS
Conocer e identificar las propiedades químicas y fisicas del carbono como fuente de hidrocarburo

¿QUE ES?
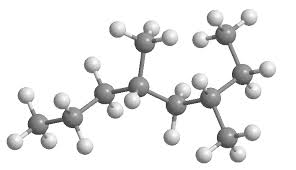
El carbono es un elemento fundamental en la formación de hidrocarburos, que son compuestos orgánicos compuestos únicamente de átomos de carbono (C) e hidrógeno (H). Estos hidrocarburos son la base de los combustibles fósiles, como el petróleo, el gas natural y el carbón, y también de muchos otros compuestos orgánicos utilizados en la industria química.
Los hidrocarburos se clasifican en dos categorías principales: los hidrocarburos saturados, conocidos como alcanos, y los hidrocarburos insaturados, que incluyen alquenos y alquinos.
La formación de hidrocarburos ocurre principalmente a través de procesos geológicos que transforman materia orgánica en petróleo y gas natural, donde el carbono desempeña un papel crucial en la estructura de estos compuestos.Además, el carbono, al ser parte de los hidrocarburos, es fundamental para la producción de energía. Cuando los hidrocarburos se queman, liberan energía a través de un proceso de oxidación, lo que los convierte en una fuente principal de energía en el mundo moderno.
Los hidrocarburos también se utilizan en la fabricación de una amplia variedad de productos químicos y materiales, lo que resalta aún más la importancia del carbono en la industria.En resumen, el carbono es esencial como fuente de hidrocarburos, que son compuestos clave en la producción de energía y en diversas aplicaciones industriales.
NOMENCLATURA
La nomenclatura de los hidrocarburos es un sistema que permite identificar y clasificar estos compuestos orgánicos formados exclusivamente por átomos de carbono e hidrógeno. A continuación, se describen las principales categorías y reglas de nomenclatura:
Clasificación de los hidrocarburos:

- Hidrocarburos saturados (alcanos):
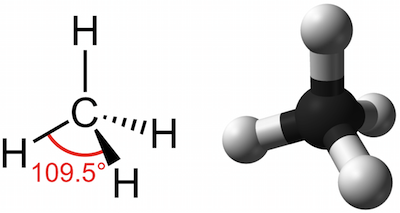
- Son compuestos en los que todos los enlaces entre los átomos de carbono son simples.
- La fórmula general es CnH2n+2CnH2n+2, donde nn es el número de átomos de carbono.
- Ejemplos incluyen el metano (CH₄), etano (C₂H₆) y propano (C₃H₈).
- Hidrocarburos insaturados:
- Se dividen en dos subcategorías:
- Alquenos: Contienen al menos un enlace doble entre carbonos. Su fórmula general es CnH2nCnH2n. Ejemplo: eteno (C₂H₄).
- Alquinos: Contienen al menos un enlace triple entre carbonos. Su fórmula general es CnH2n−2CnH2n−2. Ejemplo: etino (C₂H₂).
- Se dividen en dos subcategorías:
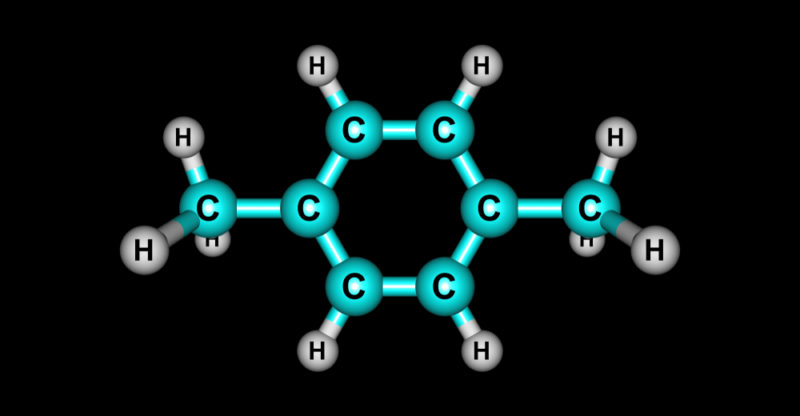
- Hidrocarburos aromáticos:
- Contienen anillos de carbono con enlaces dobles alternados, como el benceno (C₆H₆). Estos compuestos tienen propiedades químicas únicas debido a su estructura cíclica.
PROPIEDADES FÍSICAS
1. Estado físico:
- Los hidrocarburos pueden ser gases (como el metano), líquidos (como el petróleo) o sólidos (como el grafito y el carbón), dependiendo de su estructura y tamaño molecular.
2. Densidad:
La densidad de los hidrocarburos varía; por ejemplo, el petróleo es generalmente menos denso que el agua, lo que le permite flotar en ella.
3. Solubilidad:
- Los hidrocarburos son generalmente insolubles en agua, pero son solubles en disolventes orgánicos como el benceno y el éter. Esta propiedad es importante en procesos de extracción y separación en la industria química.
4. Punto de ebullición y fusión:
- Los puntos de ebullición y fusión de los hidrocarburos aumentan con el número de átomos de carbono en la cadena. Por ejemplo, los alcanos más simples tienen puntos de ebullición bajos, mientras que los hidrocarburos más complejos presentan puntos de ebullición más altos.
PROPIEDADES QUÍMICAS
1. Reactividad:
- Los hidrocarburos saturados (alcanos) son relativamente inertes, mientras que los hidrocarburos insaturados (alquenos y alquinos) son más reactivos debido a la presencia de enlaces dobles o triples. Estos enlaces permiten reacciones como la adición de halógenos o la hidratación 2.
2. Combustión:
- Los hidrocarburos arden en presencia de oxígeno, produciendo dióxido de carbono y agua. Esta reacción es exergónica y libera una cantidad significativa de energía, lo que los convierte en combustibles eficaces 2.
3. Formación de compuestos:
- Los hidrocarburos pueden reaccionar con otros compuestos químicos para formar una variedad de productos, incluyendo alcoholes, ácidos y ésteres. Esta versatilidad química es clave en la producción de productos químicos industriales.
4. Isomería:
Los hidrocarburos pueden presentar isomería estructural, lo que significa que pueden tener la misma fórmula molecular pero diferentes estructuras y propiedades. Esto es especialmente común en los alcanos y alquenos.
APLICACIONES
1. Producción de energía:
Los hidrocarburos son una de las fuentes de energía más importantes en el mundo. Se utilizan en la generación de electricidad, calefacción y como combustibles para vehículos. La combustión de hidrocarburos, como el petróleo y el gas natural, libera energía que se convierte en electricidad o se utiliza directamente para el transporte .
2. Industria petroquímica:
Los hidrocarburos son la base de la industria petroquímica, donde se utilizan como materia prima para la producción de una amplia variedad de productos químicos. Esto incluye plásticos, fertilizantes, disolventes y productos farmacéuticos. La destilación fraccionada del petróleo es un proceso clave en la obtención de estos compuestos .

3. Combustibles fósiles:
El petróleo y el gas natural, que son hidrocarburos, son considerados combustibles fósiles. Estos se utilizan ampliamente en la industria del transporte, así como en la generación de energía eléctrica. Su alta densidad energética los convierte en opciones preferidas para el transporte de mercancías y personas.
4. Producción de materiales:
Los hidrocarburos también se utilizan en la producción de materiales como el asfalto, que se emplea en la construcción de carreteras, y en la fabricación de productos como caucho y fibras sintéticas. Estos materiales son esenciales en la construcción y en la industria textil.
5. Aplicaciones en la agricultura:
En la agricultura, los hidrocarburos se utilizan para la producción de fertilizantes y pesticidas. Estos productos químicos son cruciales para mejorar la productividad agrícola y proteger los cultivos de plagas y enfermedades.
EJEMPLOS
1. Alcanos:
- Los alcanos son hidrocarburos saturados que contienen solo enlaces simples entre los átomos de carbono. Un ejemplo común es el metano (CH₄), que es el hidrocarburo más simple y se utiliza como combustible en calefacción y cocina. Otro ejemplo es el etano (C₂H₆), que se utiliza como materia prima en la producción de eteno.
2. Alquenos:
- Los alquenos son hidrocarburos insaturados que contienen al menos un enlace doble. Un ejemplo es el eteno (C₂H₄), que es un precursor clave en la producción de plásticos como el polietileno. Su reactividad permite que se utilice en reacciones de adición, lo que es fundamental en la química industrial.
3. Alquinos:
- Los alquinos son hidrocarburos insaturados que contienen al menos un enlace triple. Un ejemplo es el etino (C₂H₂), también conocido como acetileno, que se utiliza en la soldadura y como materia prima en la producción de productos químicos.
4. Hidrocarburos aromáticos:
- Los hidrocarburos aromáticos, como el benceno (C₆H₆), son compuestos que contienen anillos de carbono con enlaces dobles alternados. El benceno es un solvente común y se utiliza en la producción de productos químicos como el estireno y el fenol.
5. Hidrocarburos policíclicos:
- Estos compuestos contienen múltiples anillos de carbono fusionados. Un ejemplo es el naftaleno (C₁₀H₈), que se utiliza en la fabricación de productos químicos y como repelente de insectos. Los hidrocarburos policíclicos son importantes en la química ambiental debido a su potencial toxicidad.
6. Compuestos orgánicos volátiles (COV):
Los COV son hidrocarburos que se evaporan fácilmente a temperatura ambiente. Ejemplos incluyen el tolueno (C₇H₈) y el xileno (C₈H₁₀), que se utilizan como disolventes en pinturas y productos de limpieza.